In Europa bereits seit Mitte 2012 bindend vorgeschrieben, hat die 3. Edition der EN60601-1 – des Sicherheitsstandards für medizinische Geräte und Systeme – weltweit für Disharmonien gesorgt. Denn der neue Standard ist keineswegs so einheitlich wie erhofft.
An Standards ist die Hoffnung geknüpft, innerhalb ihres Geltungsbereichs für einheitliche Regeln und Transparenz zu sorgen. Diese Erwartung galt auch für die 3. Edition der EN60601-1. Doch rund 35 Jahre nach der Erstveröffentlichung der IEC/UL 60601 und nach Jahren der Vorbereitung gibt es erstaunliche Unterschiede: Während in Europa die aus dem Jahr 1995 stammende 2. Edition bereits am 1. Juni 2012 „einkassiert“ und durch die 3. Edition ersetzt wurde, haben sich die USA ein zusätzliches Jahr Schonfrist genehmigt. Dort tritt die neue UL60601-1 erst zum 1. Juli dieses Jahres in Kraft.
Und es gibt einen weiteren Unterschied: Während in Europa alle Geräte betroffen sind, die ’neu in Verkehr‘ gebracht werden – also auch neue Produkte älterer Bauart – gilt die 3. Edition in den USA nur für Neuentwicklungen. Kanada hat beim entsprechenden CAN/CSA-Standard einen Mittelweg gewählt. Im Datum ist man Europa gefolgt – der Standard ist also bereits seit Mitte letzten Jahres in Kraft – bei der Gültigkeit nur für Neuentwicklungen dagegen hat man sich an den USA orientiert.
Da medizintechnische Produkte oft fünf bis zehn Jahre im Verkaufsprogramm bleiben, wird gerade der letzte Punkt zum kostspieligen Nachteil für europäische Hersteller. Dies nicht nur, weil ältere Entwicklungen mit teureren Komponenten nachzurüsten sind, sondern auch wegen hoher Kosten für die neuerliche Zertifizierung solcher Produkte. Dies belastet insbesondere kleinere Unternehmen, die oft vor der Entscheidung stehen, aktuelle Produkte vorzeitig vom Markt zu nehmen, während ihre amerikanischen Wettbewerber weiter ihre älteren Produkte verkaufen dürfen.
Noch unübersichtlicher wird das Thema bei Geräten, für die zusätzlich auch die EN/UL 60601-2 relevant ist. Für diese Produkte ist die 3. Edition erst dann verbindlich vorgeschrieben, wenn die 2. Edition für 60601-2-Produkte vom Tisch ist, was durchaus später sein kann. Auch haben einige Länder die 3. Edition nicht oder noch nicht eingeführt, sodass Produkte dort weiter nach der 2. Edition zertifiziert werden. Es wird im Bereich der Medizintechnik also weiterhin mit zweierlei Maß gemessen.
Während sich im Bereich der technischen Spezifikationen für Isolation praktisch nichts geändert hat, rückt als wesentliche Neuerung das Thema „Risk Management“ ins Blickfeld. Hersteller von medizinischem Gerät müssten zukünftig einen Risk Management Prozess dokumentieren, der dem Modell der ISO 14971 folgt. Neben der Einhaltung fundamentaler technischer Standards müssen nun auch spezifische Prozesse dokumentiert und beachtet werden.
Ein Beispiel: Durften bislang Geräte während der Tests gemäß den Vorgaben der 2. Edition noch durchaus kaputt gehen, solange die Sicherheit von Patient und Bedienpersonal gesichert war, so fordert die 3. Edition nun zusätzlich, dass die Funktionalität des Systems erhalten bleibt. Diese muss in einer Risk Management File (RMF) dokumentiert sein. Dies erfordert während des gesamten Entwicklungsprozesses zukünftig weit mehr Kontakte zwischen Hersteller und Prüfstelle, zumal Erkenntnisse aus dem Prüfprozess ins RMF-Dokument einfließen müssen.
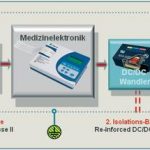
Im Bereich der für Power-Module wichtigen elektrischen Sicherheit sind für Geräte mit Patientenkontakt (MOPP = Means of Patient Protection) zwei Isolationsbarrieren vorgeschrieben. Die erste auf der Versorgungsseite wurde bislang schon durch ein ‚medizinisches‘ Netzteil realisiert. Für die zweite Isolationsbarriere zwischen Medizinelektronik und Diagnosetools – wie beispielsweise Endoskop oder EKG-Elektroden – sorgen nun „reinforced“ isolierte DC/DC-Wandler. Neu ist, dass die 3. Edition nun den Schutz für Bedienpersonal abkoppelt. Für Geräte, die nicht mit Patienten in Berührung kommen und „nur“ das Personal schützen sollen (MOOP – Means of Operator Protection), sind theoretisch Luft- und Kriechstrecken ausreichend, wie sie in der EN60950–1 für elektronische Ausrüstungen definiert sind. Dies könnte als Erleichterung interpretiert werden. Da aber zugleich die Forderung nach sehr niedrigen Ableitströmen aus der EN60601 erfüllt sein muss, ist man als Hersteller gut beraten, die Artenvielfalt einzuschränken und auch für MOOP-Geräte medizinisch isolierte Konverter-Module einzusetzen.
Als Hersteller von DC/DC-Wandlern bietet die Recom Electronic GmbH, Neu-Isenburg, ein umfangreiches Programm an medizinischen Wandler-Modulen, die entsprechend der 3. Edition mit 2xMOPP für direkten Patientenkontakt zertifiziert sind. Die Luft- und Kriechstrecken im Trafo solcher „reinforced“ isolierter Wandler müssen rund dreimal größer sein als dies für industriellen Einsatz vorgeschrieben ist. Hierfür wurden Primär- und Sekundärwicklung bislang auf entgegengesetzte Hälften eines Ringkerns gewickelt und in der Mitte durch einen Steg getrennt. Damit ist das Thema Isolation zwar erledigt, aber durch die räumliche Trennung der beiden Wicklungen können sich die Magnetfelder nicht mehr optimal überlagern. Der unangenehme Nebeneffekt: Der Wirkungsgrad solcher Trafos sinkt mit der Konsequenz höherer Wärmeverluste.
Ingenieure von Recom haben inzwischen einen Klein-Trafo entwickelt, bei dem Primär- und Sekundärwicklungen so ineinander verzahnt sind, dass sich die beiden Magnetfelder trotz der für „reinforced“-Isolation vorgeschriebenen Luft- und Kriechstrecken nahezu optimal überlappen können. Durch eine ‚quasi-resonante‘ Schalttopologie erzielen die neuen Wandler 15 bis 20 % mehr Leistung im selben Gehäuse und sind aufgrund der geringeren Wärmeverluste für Umgebungstemperaturen bis + 85 °C zugelassen – rund 15 °C mehr als bei Wandlern mit konventionellem Ringkern-Trafo üblich. Gleichzeitig konnte die Wicklungskapazität typabhängig auf Werte bis 1,5 pF reduziert werden, was für niedrigere Ableitströme sorgt, wie sie in der Medizinelektronik erwünscht sind.
Auf diesem neuen Trafokonzept basiert eine komplette Generation hoch isolierter Wandler für medizinische Applikationen wie in Programmiergeräten für Herzschrittmacher, Blutgas-Analysern oder Oxi-Metern. Die Serien Rxx/Pxx und Rxx/P2xx decken die 1- und 2-Watt-Klasse ab und sind im SIP7-Gehäuse lieferbar. Die 2-W-Version gibt es als RV-Serie auch im DIP24-Gehäuse. Die Serien REC3.5 und REC6 leisten 3,5 W und 6 W und verfügen ebenfalls über ein DIP24-Gehäuse.
Reinhard Zimmermann Recom Electronic, Neu-Isenburg
Ihr Stichwort
- Sicherheitsstandard
- Elektronische Bauteile
- Reinforced-Isolation
- Nachteile für europäische Hersteller
Unsere Whitepaper-Empfehlung
Was leisten additive Fertigungstechnologien heute? Mit der neuen Projektionsmikro-Stereolithografie lassen sich Mikroteile als Prototypen oder Serienteile in höchster Genauigkeit und Präzision fertigen. Dies lohnt sich selbst bei kleinen und mittleren Serien. Mehr erfahren Sie…
Teilen: