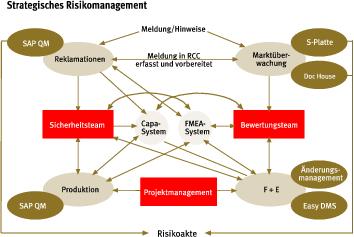
In ein SAP-basiertes System für Qualitätssicherung und Risikomanagement hat Aesculap die Möglichkeiten zur Marktüberwachung integriert. Die Risikoakte per Knopfdruck ist das Ziel der Anstrengungen.
Alle produktspezifischen Informationen in einem System abzurufen: Dieses Ziel hat sich die Tuttlinger Aesculap AG & Co. KG für ihr Qualitäts- und das Risikomanagement gesetzt. So sollen zu einer Artikelnummer „mehr oder weniger auf Knopfdruck“ alle Daten zur Verfügung stehen, die unter anderem auch für die Risikoakte gefordert werden.
„Wir arbeiten seit etwa vier Jahren daran, so ein System auf der Basis von SAP zu komplettieren“, erläutert Konrad Kobel, Bereichsleiter Qualitätsmanagement/Regulatory Affairs bei der B.Braun-Tocher Aesculap. Corrective and Protective Actions (CAPA), die Prozess-FMEA und die Produkt-FMEA, die Reklamationen sowie die Änderungen am Produkt sollen dann ohne den Wechsel von einem System zum anderen aufgerufen werden können. „Wir gehen davon aus, dass uns dieser Ansatz nicht nur Ansatzpunkte für Verbesserungen, von der Entwicklung über die Fertigung bis zu Qualitätssicherung, bringen wird“, so der Leiter des Qualitätsmanagements weiter. Auch beim alle fünf Jahre fälligen Nachzertifizieren der vielen Klasse-III-Produkte, die Aesculap im Portfolio hat, rechnet er mit erheblichen Arbeitserleichterungen.
Auch wenn bisher erst rund 60 % der geplanten Funktionen im Betrieb sind, seien die Effekte schon zu spüren. „Wir bekommen einfach und relativ schnell einen Überblick darüber, was mit einem Produkt passiert ist.“ Und da der Vorteil für alle Mitarbeiter so offensichtlich ist, sei die Umstellung von einer papierbasierten Lösung auf die Software-Version auch sinnvoll. Seit im April 2004 die DIN EN ISO 14971 in Kraft trat, arbeitet Aesculap mit dem Software-basierten System. Die Norm schreibt den Herstellern von Medizingeräten ein umfassendes Risikomanagement vor, das sich über den gesamten Lebenszyklus erstreckt. Bei den Tuttlingern sind davon rund 45 000 Produkte betroffen – darunter chirurgische Instrumente, orthopädische Implantate, Endoskope, Motorensysteme sowie Produkte für die Gefäßtherapie und Nahtmaterialien.
„Die neue Dimension war damals, dass wir nicht nur nachträglich, sondern auch vorbeugend, schon vom Entwicklungsstadium an, den Fehlerwahrscheinlichkeiten nachgehen und sie ausschließen“, sagt Kobel. Dafür vertraute Aesculap bereits der in der Industrie bewährten Methode der Fehlermöglichkeits- und Einflussanalyse (FMEA). Die Fehleranalyse beginnt schon mit den ersten Entwürfen in der Designphase und reicht über Planung und Produktion bis hin zu den Post-Market-Aktivitäten. Jede mögliche Gefährdung und die dazu vorgenommenen Gegenmaßnahmen lassen sich zurückverfolgen. „Allerdings dokumentierten wir die potenziellen Schwachstellen zunächst über Formblätter. Dies erwies sich jedoch als sehr starr und umständlich“, berichtet Kobel. Das softwaregestützte Werkzeug sollte das Qualitätsmanagement zentral abbilden und von allen beteiligten Mitarbeitern gepflegt und genutzt werden. Daraus erwachse ein ständig aktualisiertes Wissensmanagement, in dem alle gelernten Lektionen zu Prozessen und Produkten zu finden sind. Das in Zusammenarbeit mit Aesculap entwickelte System „IQOS FMEA“ steht allen Fertigungsstätten zur Verfügung. Damit hat das Unternehmen das „strategische Risikomanagement“ in die Tat umgesetzt. Das schließt heute auch die der Produktion nachgelagerten Phasen ein – wie zum Beispiel die Marktüberwachung, wie sie von gesetzlicher Seite gefordert wird.
Dieses Thema stand beim Ausbau und der Weiterentwicklung des Systems in den vergangenen Jahren im Vordergrund. „Wenn wir erfassen wollen, was mit unseren Produkten im Markt geschieht, ist eine Reihe von Punkten zu beachten“, sagt Kobel. Das Vigilanzsystem, also die Berücksichtigung meldepflichtiger Vorkommnisse, das Einleiten von Maßnahmen oder gar ein Rückruf, seien dabei wichtige Aspekte, aber nicht die Einzigen. Darüber hinaus gebe es eine Reihe nützlicher Informationsquellen. „Wenn wir etwas verbessern wollen, müssen wir Reklamationen und auch Negativinformationen aus dem Markt berücksichtigen“, so der Tuttlinger. Gespräche auf Kongressen, Artikel in den Medien oder die Fehler der Wettbewerber, die sich eventuell aus Hinweisen auf den Internet-Seiten von BfArM oder FDA ableiten lassen, könnten ebenfalls dazu beitragen, die Produkte und gegebenenfalls auch die Prozesse zu optimieren.
Diesen Informationsaustausch sieht Kobel sowohl als Holschuld der Hersteller wie auch als Bringschuld der Anwender. „Unter Marktüberwachung verstehen wir nicht die pro-aktive Suche von Problemen bei den Anwendern vor Ort oder in den Krankenhäusern, sondern wir beschränken uns darauf, die Hinweise der Anwender aufzunehmen und darauf zu reagieren.“
Damit diese Hinweise aufgenommen werden können, müssen die zumeist unstrukturierten Informationen der Kunden kanalisiert werden – und dabei sei das Software-basierte System eine große Hilfe. „In den meisten Krankenhäusern gibt es schließlich nicht den einen kompetenten Ansprechpartner, an den man sich als Hersteller wenden kann, wenn man weitere Informationen zu einem Hinweis braucht“, erzählt Kobel. Da falle vielmehr ganz nebenbei mal eine Bemerkung wie: „Die Verpackung für Produkt X hat sich wohl jemand ausgedacht, der noch nicht operiert hat. Eine zierliche OP-Schwester kriegt die gar nicht auf.“ Oder es bemängelt jemand, dass „der Hinweis auf Y wohl nicht kleiner“ hätte gedruckt werden können. Über das strategische Risikomanagement sind auch solche Informationen einfach zu verarbeiten.
Interesse an diesem System sei aus dem Medizintechnik-Markt zu spüren – Anfragen gehen laut Kobel auch bei ihm ein. Diese Erfahrung haben auch die Software-Entwickler der Freiberger SAP Consulting gemacht, die diese Lösung zunächst als Add-on speziell für Aesculap aufgebaut hatten. „Da es so viele Vorteile bietet, FMEA in das SAP-System zu integrieren, haben wir dafür inzwischen eine standardisierte Version vorbereitet“, sagt Dr. Gerhard Kicherer von SAP Consulting. Diese werde ab Juni verfügbar sein, und zwar im Erweiterungspaket 3 für Nutzer der SAP ERP Basis Release 6.0. „Jeder, der diese Basis-Version hat und das Erweiterungspaket nutzen will, kann dann auf das FMEA-Cockpit zugreifen.“ Dieses ist als Teil des SAP-QM-Moduls konzipiert.
Trotz der Unterstützung durch die Software sieht Aesculap-Mitarbeiter Kobel aber Grenzen für das, was ein Medizintechnik-Unternehmen in Sachen Marktüberwachung leisten kann. Bei einem Portfolio mit so vielen verschiedenen Produkten sei der Anspruch, eine echte Marktüberwachung zu betreiben, schwer zu erfüllen. „Daher kommt man nicht darum herum“, sagt der Tuttlinger, „einen strategischen Ansatz für das produktspezifische Risikomangagment zu definieren, und das haben wir bei Aesculap getan.“
Dr. Birgit Oppermann birgit.opperman@konradin.de
Strategisches Risikomanagement schließt Marktüberwachung mit ein
Software im Dienst des QM

Der Ursprung der Qualitätssicherung liegt darin, fertige Produkte zu prüfen. Erst viel später wurden – wie durch internationale Normen gefordert – auch Unternehmungsprozesse betrachtet.
Für die Entwicklung der Software-basierten FMEA wurde SAP als Partner ausgewählt, da bereits SAP als ERP-System genutzt wurde. Somit versprach ein SAP-basiertes Qualitätsmanagement weniger Aufwand und Kosten insbesondere bei Lizenzen, Schulungen sowie den Schnittstellen- und Anpassungsarbeiten. Die Lösung wurde als Kundenprojekt gemeinsam von Aesculap und SAP Consulting entwickelt.
Nachdem die Benutzeranforderungen definiert waren, wurde die Anwendung innerhalb von sechs Monaten implementiert – als erste FMEA-Beratungslösung, die die Walldorfer für Hersteller medizinischer Produkte umsetzten.
Aesculap verfügt seither über ein integriertes Qualitätsoptimierungssystem, das die FMEA-Methodik (IQOS FMEA) einbindet. Seit 2005 ist es in die bestehende SAP-gestützte Fertigung eingebunden und soll zukünftig auch im Produktentwicklungsprozess eingebunden werden.
Aus Expertensicht

Herr Kobel, welche Rolle wird das Software-gestützte Risikomanagement in Zukunft spielen?
Es wird uns zeigen, an welchen Stellen wir ansetzen können, um unsere Produkte über den gesamten Lebenszyklus hinweg zu verbessern.
Wie offen ist Ihr System für mögliche, kommende Erweiterungen?
Vom Ablauf her sind wir durchaus in der Lage, Erweiterungen zu tätigen. Die Grenze wird durch das System aufgezeigt, welches nicht ohne zusätzliche Kosten einfach anzupassen ist.
Ließe sich so ein System auf lange Sicht auch nutzen, um vernetzt zu arbeiten und sogar Meldungen an das BfArM automatisiert weiterzuleiten?
Diesen Aspekt kann ich gegenwärtig nicht erkennen, da auch unterschiedliche Systeme genutzt werden. Firmenintern ist durch die Nutzung des gleichen Systems eine Vernetzung durchaus praktikabel.
Ihr Stichwort
• Qualitätssicherung
• Risikomanagement
• Software-Unterstützung
• Marktüberwachung
• FMEA-Cockpit als Standard
Teilen: