Aktualisierung vom 6. Mai 2022:
Mit dem Medtec Live Talent Award wurden Veronika Spieker, Sebastian Dörrich und Alexander Schneider für ihre Studien-Abschlussarbeiten ausgezeichnet.
Bis Mitte März lief die Bewerbungsfrist für den diesjährigen Talent Award, der anlässlich der Messe Medtec Live with T4M in Stuttgart verliehen wird. Teilnehmen konnten Studierende, die ihre Abschlussarbeit im Bereich Medizintechnik angefertigt haben. In Frage kamen Bachelor- und Masterarbeiten, die sich auf eine Innovation, Verbesserung oder neue Anwendungen in der Medizintechnik mitsamt ihrer gesamten Wertschöpfungskette beziehen und die innerhalb der vergangenen 1,5 Jahre fertiggestellt wurden
Aus den eingereichten Arbeiten hat die Jury inzwischen die fünf Absolventen ausgewählt, die sich mit ihrer Arbeit dem Messepublikum in Stuttgart am 3. Mai ab 15:15 Uhr im Messeforum präsentieren werden. Das Themenspektrum reicht dabei von der Validierung einer KI in der Medizintechnik bis zu individuell angepassten Implantaten. Die Preisverleihung ist im Anschluss an die Vorträge geplant und beginnt um 16:30 Uhr ebenfalls im Messeforum. (op)
Fünf Nominierte, ihre Themen – und die Jury
Gleich zum Thema springen – oder mehr zur Jury erfahren
Sebastian Dörrich: Schneller zur korrekten Darstellung der Wirbelsäule
Florian Neumeier: So lässt sich eine KI konform zu Regularien validieren
Alexander Schneider: Mit Sensoren auf der Spur des Kapselendoskops
Veronika Spieker: Mit Mustererkennung die Prothese besser im Griff
Janick Zehnder: Bessere Implantate für die Schulter
Rückblick: Interview mit der Gewinnerin aus dem Jahr 2021
Sebastian Dörrich: Schneller zur korrekten Darstellung der Wirbelsäule

(Bild: Sebastian Dörrich)
Mobile C-Bogen-Systeme sind die Standard-Bildgebungsgeräte im Bereich der Wirbelsäulenchirurgie und ermöglichen auch 3D-Scans. Damit der Chirurg die Bilder betrachten kann, müssen die aufgenommenen Volumina so eingestellt sein, dass ihre anatomischen Standardebenen mit den Achsen der Betrachtungsmodalität übereinstimmen. Bis jetzt macht der Arzt das manuell – was pro anatomischer Struktur, die betrachtet werden soll, bis zu dreieinhalb Minuten in Anspruch nehmen kann. Wie lange es im Einzelfall dauert, hängt stark von den Fähigkeiten des Chirurgen ab.Schneller sollte das gehen, wenn eine zuverlässige Methode zur Verfügung stünde, die eine automatische Regression von Standardebenen ermöglicht.
Einen solchen präzisen sowie schnellen Algorithmus zu entwickeln, war das Ziel der Masterarbeit, die Sebastian Dörrich an der Friedrich-Alexander-Universität Erlangen-Nürnberg erstellt hat. Der Algorithmus soll die automatische Standardebenenregression von Wirbelkörpern innerhalb intraoperativer CBCT-Volumina ermöglichen.
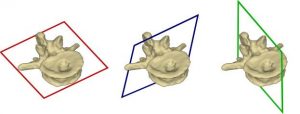
(Bild: Sebastian Dörrich)
Dafür wurden zwei Ansätze verfolgt. Der erste basiert auf einer Yolov3-Architektur. Der Algorithmus zur Objekterkennung ist an 3D-Eingaben angepasst. Der zweite Ansatz ist 3D-U-Net-basiert.
Beide Algorithmen wurden anhand eines Datensatzes von 440 Daten trainiert und auf 218 Volumina getestet. Dabei zeigte sich, dass der Objekterkennungsalgorithmus besonders schnell ist: Er brauchte nur 28 s, um zu Resultaten zu kommen.
Der U-Net-basierte Algorithmus benötigte 37 bis 63 s – er war aber besser bei der Erkennungsgenauigkeit, der Lokalisierungsgenauigkeit und der Ausrichtungsgenauigkeit.
Alles in allem erzielen beide Ansätze adäquate Ergebnisse – und sie sind schneller als die Mediziner bei der Standardebenextraktion. Somit könnten sie den 3D-Bewertungsworkflow in orthopädischen Operationen an der Wirbelsäule vereinfachen.
Florian Neumeier: So lässt sich eine KI konform zu Regularien validieren

(Bild: Florian Neumeier)
Wie lässt sich nachweisen, dass ein System mit Künstlicher Intelligenz (KI) genau das tut, was für die Medizin erforderlich ist? Mit dieser Frage hat sich Florian Neumeier in seiner Masterarbeit an der M3i Industrie-in-Klinik-Plattform in München befasst.
Dabei ging es um eine KI-basierte Innovation aus der Medizintechnik, die beim präzisen Entfernen von Hauttumoren unterstützen soll. Bevor solche Systeme am Markt zugelassen und in der Praxis eingesetzt werden können, müssen sie eine klinische Validierungsstudie durchlaufen.
Um zu sehen, wie sich so eine Studie konzeptionieren und durchführen lässt, wurden im Rahmen der Arbeit der klinische Workflow und die Integration der KI-Innovation evaluiert und ein geeigneter Studienaufbau erstellt.
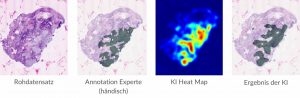
(Bild: Florian Neumeier)
Einerseits ging es um die menschliche Einschätzung: Ausgangspunkt waren 39 klinische konfokalmikroskopisch aufgenommene Bilddatensätze. Darin galt es, 117 diagnostisch relevante Bereiche zu beurteilen. Drei klinische Experten des Klinikums der Universität München und der Stanford University stellten jeweils eine Diagnose und entschieden, ob dort ein Tumor zu sehen war oder gesundes Gewebe.
Im Anschluss war ein KI-Algorithmus am Zug. Dieser wurde im Rahmen der Forschungsprojekte Skin-ID und Konfident entwickelte und stellte ebenfalls seine Diagnosen.
Wie gut die Experten untereinander und mit dem Ergebnis der KI-Diagonse übereinstimmten, ließ sich mittels statistischer Messwerte beurteilen. Eingesetzt wurden das Overall Percentage Agreement und Cohen’s Kappa. Dabei kam die KI im Vergleich mit den Experten zu überzeugenden Ergebnissen.
Für eine Zulassung und Markteinführung der Innovation ist jedoch eine Entwicklung und Validierung mit einer größeren Menge an klinischen Daten erforderlich. Dem Aufbau des entwickelten Experiments kann aber grundsätzlich gefolgt werden.
Alexander Schneider: Mit Sensoren auf der Spur des Kapselendoskops

(Bild: Alexander Schneider)
Um Erkrankungen des Magen-Darm-Trakts zu untersuchen, bietet die Kapselendoskopie neue Möglichkeiten. Der Patient schluckt dafür eine pillengroße Kapsel mit integrierter Kamera, einem Magneten und einem drahtlosen Sender. Die Kapsel legt ihren Weg durch den Verdauungstrakt zurück. Wenn die Kamera dabei Bilder erzeugt, die eine Operation erforderlich erscheinen lassen, muss der Mediziner die Position des betroffenen Bereichs im Darm genau kennen.
Das Tracking der Kapseln war bisher aber ein Problem. Die besten Ergebnisse versprechen dabei Methoden, die auf Magnetismus setzen: Den Permanentmagnet in der Kapsel erfasst dabei eine starre Sensoranordnung außerhalb des Körpers anhand seines Magnetfeldes. Aus diesen Messungen lassen sich Position und Orientierung der Kapsel relativ zum Sensorarray schätzen.
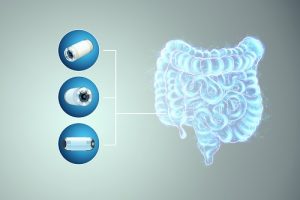
Doch während der 8 bis 12 Stunden, die die Kapsel für ihren Weg braucht, sollte der Patient seinem Alltag nachgehen könne. Das Lokalisierungssystem muss daher tragbar und robust sein. Bewegungen des Patienten können das Sensorarray aber relativ zur Bauchoberfläche verschieben und so zu falschen Angaben über die Position der Kapsel führen.
Drei magnetische Objekte sollen die Position wiedergeben
Wie sich solche unerwünschten Bewegungen kompensieren lassen, hat Alexander Schneider in seiner Masterarbeit an der Friedrich-Alexander-Universität Erlangen-Nürnberg getestet. Er nutzte dabei drei magnetische Objekte. Neben dem Permanentmagneten in der Kapsel waren auf der Bauchdecke zwei Referenzspulen befestigt, die mit Wechselstrom (AC) gespeist und abwechselnd ein- und ausgeschaltet wurden.
Damit ließ sich ein Referenzkoordinatensystem definieren, um den Permanentmagneten in Bezug auf die beiden Referenzspulen zu lokalisieren. Da davon ausgegangen wird, dass die Spulen fest am Körper angebracht sind, werden Relativbewegungen kompensiert.
Die Ergebnisse zeigten, dass der Positionsfehler der Kapsel bei Anwendung der Kompensationsmethode von im Durchschnitt etwa 40 mm um den Faktor 10 auf etwa 4 mm reduziert werden konnte. Das verspricht daher eine ausreichende Genauigkeit für den angestrebten klinischen Einsatz.
Die Lösung ist als Wearable-System für den Einsatz in Alltagssituationen der Patienten geeignet. Zukünftige Forschungsarbeiten könnten sich auf die Entwicklung von planaren Referenzspulen konzentrieren, die an der Bauchoberfläche angebracht werden.
Veronika Spieker: Mit Mustererkennung die Prothese besser im Griff

(Bild: Veronika Spieker)
Handprothesen können Menschen, die Gliedmaßen verloren haben, dabei helfen, im täglichen Leben selbstständiger zu sein. Moderne Prothesen ermöglichen verschiedene Greifbewegungen, die intuitiv mittels Muskelkontraktionen am Armstumpf gesteuert werden. Algorithmen zur Mustererkennung (pattern recognition) sind besonders vielversprechend, wenn es darum geht, die gewünschte Handbewegung zu erkennen.
Während so eine Prothesensteuerung im klinischen Umfeld bereits robust agiert, stößt sie im Alltag noch an Grenzen. Schon eine andere Armposition kann die myoelektrischen Signalmuster beeinflussen und die Zuordnung eines Muster erschweren. Das macht aber die Steuerung weniger zuverlässig, was Nutzer frustrieren kann – sogar soweit, dass sie die neuartige Technologie gar nicht mehr nutzen möchten.

(Bild: Veronika Spieker)
In ihrer Masterarbeit an der TU München hat Veronika Spieker einen adaptiven multimodalen Algorithmus eingesetzt, der Auswirkungen von Störfaktoren begegnet. Der Algorithmus setzt nicht allein auf Muskelsignale, sondern nutzt zusätzliche kinematische Informationen. Um das Kalibrieren zu beschleunigen, werden entsprechende Daten während der alltäglichen Nutzung aufgezeichnet und verarbeitet. Sie fließen in die Kalibrierung der Prothesensteuerung ein.
Eine experimentelle Studie mittels virtuellen TAC-Tests und der Vergleich mit einer existierenden Klassifizierungsstrategie zeigte, dass die entwickelte Methode zu gesteigerten Erfolgsraten (bis zu 13 %) führt. Das spricht für eine unüberwachte Datenanpassung und künftige Entwicklung adaptiver Algorithmen, um die Translation der Prothesensteuerung mittels Mustererkennung aus dem Labor in den Alltag zu ermöglichen.
Weitere Informationen zu dieser Arbeit: https://doi.org/10.3390/s21217404
Janick Zehnder: Bessere Implantate für die Schulter

(Bild: Janick Zehnder)
Wie muss ein Implantat aussehen, mit dem sich Knochen im Schulterbereich so behandeln lässt, dass in der Folge keine Brüche auftreten? Mit dieser Frage hat sich Janick Zehnder in seiner Masterarbeit an der Fachhochschule Nordwestschweiz befasst.
Eine strukturmechanische in-silico-Studie sollte zeigen,
- wieso Akromion-Levy-Typ-II-Frakturen auftreten – also Brüche in einem bestimmten oberen Bereich des Schulterblattes (Akromion) auftreten,
- wie sich mittels Topologieoptimierung geeignete Implantate entwickeln lassen und
- welche Ergebnisse diese erzielen, verglichen mit Standardlösungen.
Dies Basis für die Arbeit waren CT-Daten einer 83-jährigen Patientin. Daraus wurde ein digitales dreidimensionales kortikales Knochenmodell erstellt, das den Schulterkomplex aus Schulterblatt (Skapula) und Schlüsselbein (Klavikula) erinfacht wiedergibt. Rekonstruierte Muskel-Kraft-Vektoren für den anterioren, mittleren und posterioren Deltamuskel wurden verwendet, um ein patientenspezifisches Finite-Element-Modell aufzubauen. Das Modell bildet das biomechanische Verhalten von Abduktion und Flexion im Bereich von 15° bis 120° ab.

(Bild: Janick Zehnder)
Winkelspezifische Spannungen und Deformationen im Levy-Typ-II-Bereich wurden in automatisierten Parameterstudien analysiert. Die Simulationsstudien zeigten, wo potenziell kritische Vergleichsspannungen auftraten, die eine Levy-Typ-II-Fraktur begünstigen könnten.
Aus diesen Erkenntnissen ließen sich topologieoptimierte Implantatlösungen ableiten. Im Vergleich zu bisherigen Lösungen überzeugten diese durch eine verbesserte anatomische Passform, eine verbesserte Massenausnutzung und homogenere Spannungsverteilungen mit potenziell verbessertem Ermüdungsverhalten.
In der Jury sind Forschung und Industrie vertreten. Zum fünfköpfigen Team gehören:
- Prof. Wolfgang Böcker, Ärztlicher Direktor der Klinik für Allgemeine, Unfall- und Wiederherstellungschirurgie im LMU Klinikum der Ludwig-Maximilians-Universität München,
- Prof. Björn Eskofier vom Machine Learning and Data Analytics (MaD) Lab der Friedrich-Alexander-Universität Erlangen-Nürnberg,
- Walter Märzendorfer, Aufsichtsratsvorsitzender des Medical Valley EMN e.V. und Non-Executive Chairman bei MRH/Blikk, einem Praxisverbund für Radiologie- und Radiotherapie,
- David Pollard, Education Lead beim Europäischen Institut für Innovation und Technologie (EIT Health) und Doktorand für Inklusives Design und kreative Technologieinnovation am Smartlab der School of Mechanical and Materials Engineering, University College Dublin (UCD) sowie
- Prof. Christoph Reiners, Seniorprofessor der Medizinischen Fakultät der Universität Würzburg.
Mehr Informationen zum Talent Award:
www.medteclive.com/de/award
Rückblick Medtec Live 2021: Dürfen wir Ihnen die Siegerin des Talent Award aus dem vergangen Jahr vorstellen?
Bei der Premiere des Young Talent Award im Jahr 2021 hat die Jury nach den Vorträgen Charlotte Pradel als Siegerin ausgewählt, die über ihre Erfahrungen im Studium und beim Wettbewerb im Interview mit medizin&technik berichtet.











