Parkinson ist nach Alzheimer die zweithäufigste neurodegenerative Erkrankung. In Deutschland sind etwa 400000 Menschen betroffen – aufgrund der zunehmenden Alterung der Gesellschaft mit steigender Tendenz. Neben dem als Tremor bezeichneten unwillkürlichen Zittern der Gliedmaßen leiden die Betroffenen insbesondere an Unterbeweglichkeit. „Sie fühlen sich steif, können Bewegungen schlechter starten und beenden, bewegen sich langsamer und haben einen unsicheren Gang, was zu Stürzen führen kann“, sagt Prof. Andrea Kühn, Leiterin der Sektion Bewegungsstörungen und Neuromodulation an der Klinik für Neurologie mit Experimenteller Neurologie der Charité. „Parkinson ist bislang noch nicht heilbar, doch viele Symptome, insbesondere die schlechte Beweglichkeit, können mit Hilfe der Tiefen Hirnstimulation deutlich verbessert werden.“
Elektroden im Gehirn gut einstellen
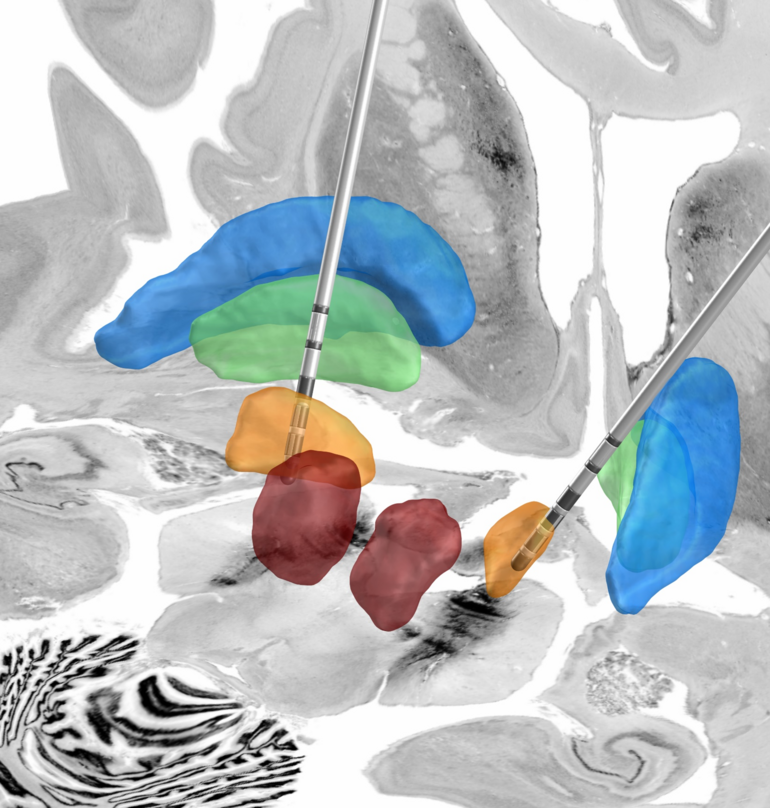
Für die Therapieform der Tiefen Hirnstimulation (THS) bekommen Patienten während eines operativen Eingriffs zwei feine Elektroden ins Gehirn implantiert. Diese geben schwache, kurze elektrische Impulse ab und stimulieren so gezielt und stetig die jeweiligen Hirnregionen. Dafür sind sie über Kabel, die unter der Haut verlaufen, an einen Schrittmacher im Brustraum angeschlossen. Über diesen lassen sich eine Vielzahl unterschiedlicher Stimulationsparameter eingestellen und individuell an die Symptomatik der Parkinson-Erkrankten anpassen. Drei Monate nach der Operation wird bei den Patienten während eines mehrtägigen Klinikaufenthaltes in einem THS-Zentrum die für sie bestmögliche Einstellung ausgetestet. „Um diesen Prozess künftig effizienter und letztlich auch für die Patientinnen und Patienten angenehmer gestalten zu können, haben wir die Software Stimfit entwickelt“, sagt Jan Roediger, ebenfalls von der Sektion Bewegungsstörungen und Neuromodulation an der Klinik für Neurologie mit Experimenteller Neurologie und Erstautor der Studie.
Software berechnet auf Basis radiologischer Bilddaten des Gehirns
Die Software berechnet auf Basis radiologischer Bilddaten des Gehirns der Patienten Vorschläge für eine individuelle Stimulationseinstellung. Wichtige Parameter sind die Stromstärke und die genaue Positionierung der stimuliabgebenden Bereiche der Elektroden. Um zu prüfen, ob die softwarebasierten Einstellungen von Stimfit mit denen durch klinisches Austesten gefundenen Einstellungen qualitativ mithalten können, hat das Forschungsteam eine Studie mit 35 Parkinson-Patienten durchgeführt. Beide Stimulationseinstellungen – die jeweils individuelle, die durch die herkömmliche klinische Testung erstellt wurde, sowie die softwarebasierte Einstellung – wurden nacheinander getestet. Im Anschluss wurden die motorischen Symptome nach den beiden Einstellungen beurteilt und miteinander verglichen. „Die allgemeine Beweglichkeit und insbesondere auch das Laufen der Patientinnen und Patienten verbesserte sich bei beiden Stimulationseinstellungen gleich gut“, sagt Prof. Kühn. „Das ist ein wirklich vielversprechendes Ergebnis. Bildgebungsbasierte Algorithmen könnten die klinische Praxis der THS bei Parkinson und anderen Bewegungsstörungen künftig deutlich vereinfachen und es so ermöglichen, die neuesten technischen Fortschritte – wie etwa Mehrkontaktelektroden zur direktionalen Stimulation – besser zu nutzen.“
Kontakt:
Charité – Universitätsmedizin Berlin
Prof. Dr. Andrea Kühn
Klinik für Neurologie mit Experimenteller Neurologie
Telefon: +49 (0)30 450 560 203
E-Mail: andrea.kuehn@charite.de
https://neurologie.charite.de
https://doi.org/10.1016/S2589–7500(22)00214-X
https://sfb-retune.de/