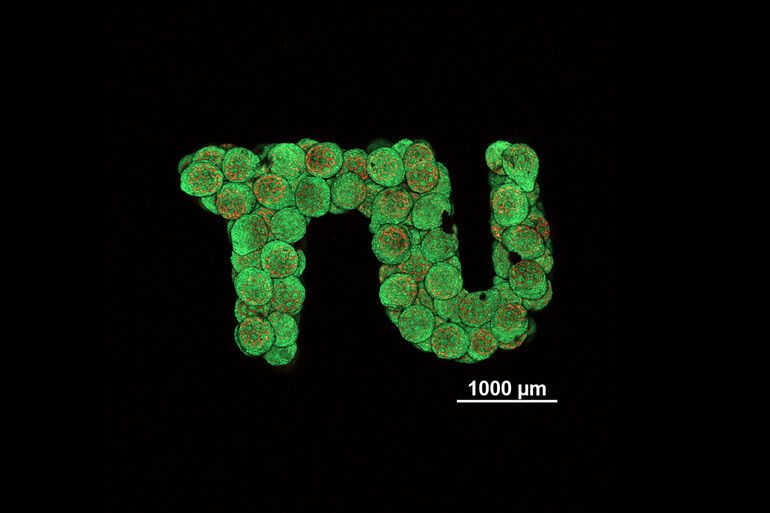
Kann man Gewebe im Labor nach einem vorgegebenen Plan wachsen lassen, zum Beispiel um verletzten Knorpel zu ersetzen? An der TU Wien gelang ein wichtiger Schritt in Richtung Ersatzgewebe aus dem Labor – und zwar mit einer Technik, die sich von anderen Methoden deutlich unterscheidet.
Mittels eines speziellen Präzisions-3D-Druckverfahrens lassen sich winzige, poröse Kügelchen aus biologisch verträglichem und abbaubarem Kunststoff erzeugen. Zellen können diese besiedeln. Ordnet man die Kügelchen in beliebiger Geometrie an, verbinden sich die Zellen der unterschiedlichen Einheiten lückenlos zu einem einheitlichen, lebenden Gewebe. Gerade Knorpelgewebe, mit dem das beschriebene Konzept nun an der TU Wien demonstriert wurde, galt in dieser Hinsicht bisher als besonders herausfordernd.
Tissue Engineering: Winzige 3D-Druck-Kugel-Käfige bilden Gerüst für Zellen
„Knorpelzellen aus Stammzellen zu kultivieren, ist dabei gar nicht die größte Herausforderung. Das Hauptproblem ist, dass man normalerweise wenig Kontrolle darüber hat, welche Form das entstehende Gewebe dann annimmt“, sagt Dipl.-Ing. Oliver Kopinski-Grünwald vom Institut für Werkstoffwissenschaften und Werkstofftechnologie der TU Wien. „Das liegt auch daran, dass solche Stammzellklumpen im Lauf der Zeit ihre Form verändern und oft schrumpfen.“
Um das zu verhindern, arbeitet das Forschungsteam an der TU Wien mit dem neuen Ansatz: Mit speziell entwickelten Laser-basierten Präzisions-3D-Drucksystemen werden winzige Käfig-artige Strukturen erzeugt, die wie Mini-Fußbälle aussehen. Sie haben einen Durchmesser von nur einem Drittel Millimeter. Sie dienen als Stützstruktur und bilden kompakte Bausteine. Diese können zu beliebigen Formen arrangiert werden.
In diese fußballförmigen Mini-Käfige werden zunächst Stammzellen eingebracht, die das winzige Volumen rasch vollständig füllen. „Wir können auf diese Weise also erstmals zuverlässig Gewebe-Konstrukte erzeugen, in denen die Zellen ganz gleichmäßig verteilt sind und die Zelldichte sehr hoch ist. Mit bisherigen Ansätzen wäre das nicht möglich“, erklärt Univ. Prof. Aleksandr Ovsianikov, Leiter der Forschungsgruppe 3D Printing and Biofabrication an der TU Wien.
Zellen in den Käfigen verwachsen zu einem Gewebe in gewünschter Form
Das Team verwendete dafür differenzierte Stammzellen. Das sind Stammzellen, die sich nicht mehr zu jeder beliebigen Art von Gewebe entwickeln können, sondern schon auf einen bestimmten Gewebetyp festgelegt sind, in diesem Fall auf Knorpelgewebe. Solche Zellen sind für medizinische Anwendungen besonders interessant. Doch gerade bei Knorpelzellen gilt das Konstruieren größerer Gewebe als sehr herausfordernd. Im Knorpelgewebe bilden die Zellen nämlich eine besonders ausgeprägte extrazelluläre Matrix, eine geflechtartige Struktur zwischen den Zellen. Sie hindert die unterschiedlichen Zellkügelchen oft daran, auf gewünschte Weise miteinander zu verwachsen.
Zellen verschiedener Kügelchen verwischen die Grenzen
Dass auch Zellen unterschiedlicher 3D-gedruckter poröser Kügelchen auf gewünschte Art zu einem einheitlichen, homogenen Gewebe verwachsen, konnten die Forscher nun zeigen. Kopinski-Grünwald berichtet: „Unter dem Mikroskop sieht man ganz klar: Benachbarte Kügelchen verwachsen, die Zellen wandern von einem Kügelchen ins andere und umgekehrt, sie verbinden sich nahtlos und ergeben eine geschlossene Gesamtstruktur ohne Hohlräume.“ Das stehe ganz im Gegensatz zu anderen Methoden, die es bisher gab, bei denen sichtbare Schnittstellen zwischen benachbarten Zellklumpen bleiben.
Die winzigen Stützelemente aus dem 3D-Druck verleihen der Gesamtstruktur mechanische Stabilität, während das Gewebe weiter ausreift. Im Lauf der Zeit bauen sich die Kunststoffstrukturen selbstständig ab. Über einen Zeitraum von Monaten verschwinden sie einfach und lassen das fertig geformte Gewebe in gewünschter Form zurück.
Tissue Engineering: Erster Schritt Richtung medizinische Anwendung
Der neue Ansatz ist prinzipiell nicht nur auf Knorpelgewebe beschränkt, daher könnte man auf diese Weise auch andere größere Gewebe wie beispielsweise Knochengewebe maßschneidern. Auf dem Weg dorthin gibt es allerdings noch einige Aufgaben zu lösen – schließlich müssten für diese Gewebe, anders als in Knorpelgewebe, ab einer gewissen Größe auch Blutgefäße mit eingebaut werden.
„Ein erstes Ziel wäre, kleine maßgeschneiderte Knorpelgewebsteile zu produzieren, die man nach einer Verletzung in bestehendes Knorpelmaterial einsetzen kann“, sagt Oliver Kopinski-Grünwald. „Wir konnten nun jedenfalls zeigen, dass unsere Methode zur Herstellung von Knorpelgewebe mit Hilfe kugelförmiger Mikro-Gerüsten, prinzipiell funktioniert und gegenüber anderen Technologien entscheidende Vorteile hat.“
Wissenschaftliche Ansprechpartner:
Prof. Aleksandr Ovsianikov
Institut für Werkstoffwissenschaft und Werkstofftechnologie, Technische Universität Wien
E-Mail: aleksandr.ovsianikov@tuwien.ac.at
Oliver Kopinski-Grünwald
Institut für Werkstoffwissenschaft und Werkstofftechnologie,
Technische Universität Wien
E-Mail: oliver.kopinski-gruenwald@tuwien.ac.at