Ein unachtsamer Moment, zu spät reagiert, und schon ist es passiert: ein Sturz mit dem Fahrrad oder ein Ausrutscher auf frisch gebohnertem Boden; die Hand und das Knie aufgeschürft, eine Platzwunde an der Stirn. Doch schon nach wenigen Wochen ist nichts mehr vom Unfall zu sehen. Unser Organismus ist einfach unschlagbar gut darin, Wunden selbst zu heilen. Die Schürfwunde verkrustet. Der blaue Fleck ist bald spurlos verschwunden. Und sogar ein gebrochener Knochen heilt von allein. Keine Maschine schafft das, was für unseren Körper selbstverständlich ist: sich selbst zu reparieren. Doch dieses Wunder der Selbstheilung hat seine Grenzen. Denn nicht immer gelingt es dem Körper, einen Defekt oder eine Verletzung aus eigener Kraft auszubessern. Teile des Herzmuskels etwa, die durch einen Infarkt oder eine Entzündung absterben, bleiben zerstört.
Biologen, Mediziner und Ingenieure entwickeln deshalb seit einigen Jahren Methoden, mit denen sie den Körper dabei unterstützen, Schäden zu beheben, die natürlicherweise irreparabel sind. Tissue Engineering nennen Experten diese Disziplin an der Schnittstelle zwischen Medizin und Technik, zu deutsch „Gewebezüchtung“. Die Idee besteht darin, dem Menschen einige Körperzellen zu entnehmen und diese im Labor zu größeren Zellverbänden anwachsen zu lassen, die schließlich als Gewebeersatz an jenen Stellen eingepflanzt werden, die zerstört sind.
Einsatzbereich: Neuer Knorpel für das Knie
Die Transplantation von Knorpelzellen für die Reparatur von zerstörtem Gelenkknorpel im Knie ist das erste Tissue-Engineering-Produkt, das in Deutschland von den Krankenkassen erstattet wird. Bei diesem Verfahren werden dem Patienten während einer Gelenkspiegelung kleine Mengen eigenen Knorpels entnommen.
Im Labor werden die Zellen mit Enzymen behandelt, sodass sie sich vereinzeln. Das führt dazu, dass die Zellen beginnen, sich zu teilen und neue Zellverbände zu bilden. Anschließend werden diese auf ein Trägermaterial übertragen, das gewissermaßen als Ersatzteil ins Knie implantiert werden kann. Dort bildet sich weiterer Knorpel, der den verletzten Bereich zuwächst. Oftmals werden Trägermaterialien verwendet, die sich im Körper nach und nach abbauen, während die Zellen die natürliche Funktion übernehmen. Die Entnahme körpereigener Zellen wiederum ist wichtig, um Abstoßungsreaktionen des Immunsystems zu vermeiden.
Erfolgreicher Ansatz: Herzklappenzucht
Weltweit arbeiten heute viele Forschergruppen daran, immer neue Gewebe zu züchten. Für Kinder mit angeborenen Herzfehlern ist es inzwischen gelungen, mithilfe des Tissue Engineerings Prothesen für Herzklappen zu entwickeln. Diese verwachsen mit dem Organismus der kleinen Patienten, was die bislang notwendigen wiederholten Operationen überflüssig macht. Die Klappen werden mittels biologischer Klappengerüste individuell für jedes Kind im Labor hergestellt.
Zwar waren die ersten Operationen dieser Art erfolgreich. Vor einem breiten Einsatz im klinischen Alltag aber sind noch wissenschaftliche Langzeitstudien nötig. Parallel arbeiten Forscher daran, aus so genannten Stammzellen der Patienten Herzmuskelzellen zu züchten, mit denen sich künftig zerstörtes Herzmuskelgewebe reparieren lassen soll.
Vision: Organe aus dem 3D-Drucker
Dass das Züchten von Knorpel und Herzklappen heute bereits so erfolgreich ist, liegt vor allem daran, dass diese Strukturen meist nur aus einem einzigen Zelltyp bestehen und sich mithilfe einer Trägerstuktur, dem „Scaffold“, leicht zum passenden Gewebeersatz heranzüchten lassen. Doch den Tissue-Engineering-Experten schwebt mehr vor. Ihr Fernziel ist die Züchtung ganzer Ersatzorgane, einer neuen Leber oder Niere, was künftig Organtransplantationen überflüssig machen soll.
Doch solche Organe sind komplex aufgebaut. Sie bestehen aus verschiedenen Geweben, aus unterschiedlichen Zelltypen und sind zudem von Blutgefäßen durchzogen. Lange war es undenkbar, derart filigrane Organe nachzubilden.

Doch seit der 3D-Druck in der Branche Einzug hält, erscheint die Vision des künstlichen Organs durchaus realistisch. Mit so genannten Bioprinting-Verfahren kann man heute wässrige Lösungen drucken, die Zellen enthalten. In solchen Anlagen lassen sich, wie bei den Farben beim Tintendrucker, gleichzeitig Lösungen mit verschiedenen Zellen drucken. Als Trägermaterial dienen unter anderem Hydrogele. Diese weichen Strukturen entstehen, indem man im 3D-Drucker wässrige Lösungen mit Spezialpolymeren verarbeitet, die sich zu einem Polymernetzwerk verbinden. In dieses Polymernetzwerk werden während des 3D-Drucks die verschiedenen Zellen eingebettet.
Ohne Gefäße hat ein Organ keine Chance
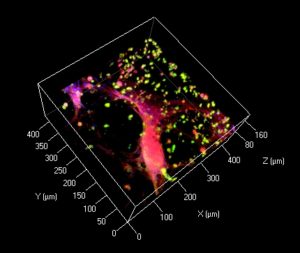
Doch ohne Blutgefäße – für die Zufuhr von Nährstoffen und den Abtransport von Stoffwechselprodukten – wird ein solches Organ nicht funktionieren. Das Team um Prof. Dr. Aránzazu del Campo Bécares vom Leibniz-Institut für Neue Materialien INM in Saarbrücken hat deshalb eine erstaunliche Methode entwickelt, mit der man künftig in Geweben oder ganzen Organen Blutgefäße wachsen lassen könnte: Die Methode zeigt den Blutgefäßen mit einem Laser, wo es lang geht.
Der Körper des Menschen ist grundsätzlich in der Lage, nach Verletzungen neue Blutgefäße zu bilden. Er schüttet zu diesem Zweck an den entsprechenden Stellen so genannte Wachstumsfaktoren aus, die jene Zellen anregen, die die Blutgefäße bilden – die Endothelzellen. Mit genau solchen Wachstumsfaktoren versehen die Saarbrücker Forscher ihre Hydrogele oder andere Trägermaterialien. Ist das Gewebe implantiert, soll es den Körper dazu anregen, neue Blutgefäße wachsen zu lassen. „Bei vielen Organen ist es aber entscheidend, dass die Blutgefäße in einer ganz bestimmten Richtung oder einem Muster wachsen“, sagt Aránzazu del Campo Bécares. „Wir müssen dem Körper deshalb mitteilen, wie die Blutgefäße wachsen sollen. Dafür benutzen wir das laseroptische Verfahren.“

Die Mitarbeiter in ihrem Team bauen zu diesem Zweck spezielle Wachstumsfaktoren in die Scaffolds ein, die erst durch eine Bestrahlung mit Laserlicht aktiv werden. Mit dem Laser lassen sich durch den Gewebeersatz also Wege bahnen, entlang derer sich neue Blutgefäße bilden sollen. Wie die Experimente in den INM-Labors zeigen, funktioniert das sehr gut. Die Endothelzellen lassen sich tatsächlich in die richtige Bahn lenken.
Optische Leiterbahnen weisen den Weg
Aránzazu del Campo Bécares kann sich vorstellen, dass man ein mit Zellen und Wachstumsfaktoren bestücktes Trägermaterial künftig vor der Operation mit dem Laser behandelt. Zum Beispiel nachdem man es direkt im OP ausgedruckt hat. Alternativ ließen sich in die Scaffolds optische Leiterbahnen drucken, in die man erst nach der Operation durch einen kleinen Zugang am Körper Laserlicht einkoppelt – und sie so aktiviert.
Biologisch abbaubare Lichtleiter gebe es bereits, sagt del Campo Bécares. „Überhaupt sind viele der für das künftige Tissue Engineering benötigten Technologien schon entwickelt. Was wir jetzt brauchen, ist eine enge interdisziplinäre Zusammenarbeit zwischen Technikern, Biologen, Chemikern und Medizinern, weil wir medizinische, zellbiologische, materialwissenschaftliche und handfeste technische Herausforderungen meistern müssen.“ Auch sollte man schon heute auf gemeinsame Standards hinarbeiten. „Noch forschen viele Gruppen an eigenen Konzepten, für eine schnelle klinische Prüfung und einen baldigen Praxiseinsatz aber brauchen wir gemeinsame Lösungen.“
Tissue Engineering bietet sich für viele Aufgaben an
Das Potenzial des Tissue Engineerings sei enorm, sagt die Polymerexpertin aus Saarbrücken. Mit ihrem Laserverfahren etwa will sie nicht nur Endothelzellen das gerichtete Wachstum beibringen, sondern beispielsweise auch Nervenfasern – um Schäden zu heilen, die durch Unfälle entstanden sind. Geschädigte Nervenzellen wachsen langsam und werden meist schnell durch den Wundheilungsprozess am Weiterwachsen gehindert, durch so genannte Fibroblasten, die die Wunde verschließen und die Nervenenden verkapseln. Eine Lösung wäre es, die geschädigte Nervenbahn mit einem Scaffold zu überbrücken, das nicht nur Wachstumsfaktoren für die Nervenzellen enthält, sondern zugleich Hemmstoffe, die das Wachstum der Fibroblasten blockieren. Auch in diesem Falle könnte man das Scaffold mit dem Laser vorstrukturieren, um den Nervenzellen die Richtung zu weisen.
Trägergewebe mit nützlichen Bakterien
Das Tissue-Engineering dürfte künftig also sehr viel mehr bieten als einen einfachen oder auch ausgeklügelten Zellersatz. So wird beispielsweise daran gearbeitet, per 3D-Druck Bakterien in das Trägermaterial einzubringen, die so verändert wurden, dass sie bestimmte Substanzen produzieren und an ihre Umgebung abgeben. Das können Wachstumsfaktoren sein, aber auch Wirkstoffe, die entzündliche Erkrankungen bekämpfen – etwa im Auge. Nach Abschluss der Behandlung könnte man die Bakterien durch einen Reiz von außen abtöten – etwa durch einen Wirkstoff oder einen Wärmeimpuls. Das implantierte Gewebe würde sich dann nach und nach abbauen.
Auch diese neuen so genannten Living Therapeutic Materials dürften die Einsatzgebiete für das Tissue Engineering deutlich erweitern. Aránzazu del Campo Bécares geht davon aus, dass schon in wenigen Jahren erste Produkte auf den Markt kommen werden. Denn viele der dafür erforderlichen Technologien seien bereits ausgereift. „Wichtig sind die Entwicklung standardisierter Trägermaterialien und klarer gesetzlicher Regelungen, um Produkte schnell in die klinische Anwendung zu bringen.“











