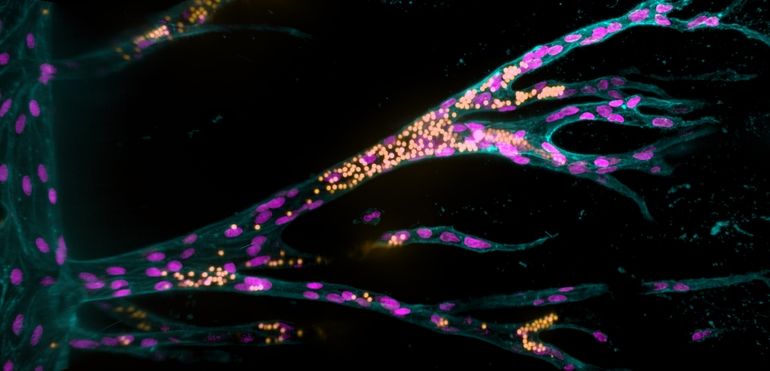
In einem Gerüst aus künstlichen Materialien kann ein funktionsfähiges Blutgefäßsystem entstehen. Das haben Forscher um die Biomedizin-Ingenieurin Dr. Britta Trappmann vom Max-Planck-Institut für molekulare Biomedizin in Münster an einem Zellkultursystem gezeigt. Dabei hat das Team untersucht, welche Materialeigenschaften einzelne Parameter der Gefäßbildung fördern. Dazu war bisher nichts bekannt. Dieses Wissen ist aber ein Schritt auf dem Weg zur Zukunftsvision implantierbarer künstlicher Gewebe: Denn funktionsfähige Gewebe können nur entstehen, wenn in ihnen Blutgefäße wachsen und sich mit dem Gefäßsystem des Organismus verbinden. Dann wird das Gewebe durchblutet und mit Sauerstoff und Nährstoffen versorgt.
Hydrogel als Umgebung für ein neues Blutgefäß im Tissue Engineering
Das Team aus Münster setzt ein spezielles Hydrogel ein, dessen Eigenschaften die Forscher kontrolliert verändern können. In das Gel ließen sie ein Ursprungsblutgefäß aus menschlichen Blutgefäßzellen wachsen.
Sie untersuchten, wie die Materialeigenschaften der künstlichen Zellumgebung die Bildung weiterer Blutgefäße beeinflussten. Demnach muss das künstliche Material bestimmte Adhäsionsmoleküle in der Membran der Blutgefäßzellen aktivieren. Nur dann wandern die Zellen in Gruppen aus dem Ursprungsgefäß aus und bilden neue röhrenförmige Strukturen. Dafür müssen die Zellen aber auch einen Teil des umgebenden Materials abbauen können, um Platz zu schaffen.
Implantierbare Gewebe als Fernziel
Die Forscher wollen nun ihr System weiter an die natürliche Umgebung von Zellen annähern. Dafür werden sie zahlreiche weitere Biomoleküle und Zellen in das Modellsystem integrieren. „Die Wirkung all dieser Faktoren ist in natürlichem Gewebe zudem gekoppelt und von Organ zu Organ unterschiedlich“, sagt Dr. Britta Trappmann. All das zu verstehen, sei ein Fernziel. Das Wissen könne man dann nutzen, um implantierbare Gewebe zu entwickeln.
Mehr über die Forscher:
www.mpi-muenster.mpg.de/229324/trappmann
Wissenschaftliche Ansprechpartner:
Dr. Britta Trappmann, Max-Planck Forschungsgruppenleiterin
Max-Planck-Institut für molekulare Biomedizin
E-Mail: britta.trappmann@mpi-muenster.mpg.de