Was in der technischen Dokumentation eines Medizinprodukts enthalten sein muss, legen die Medizinprodukte-Verordnung (Medical Device Regulation, MDR) und die ISO 13485:2016 fest. Normen wie die ISO 14971 für das Risikomanagement wiederum geben genauer vor, welche Inhalte zu dokumentieren sind und wie der Hersteller sie in unterschiedliche Dokumente aufzuteilen hat. Besonders groß ist die Herausforderung, wenn es sich um ein aktives Medizinprodukt der Klasse III handelt und dieses in unterschiedlichen Varianten auf den Markt kommt.
Wie ein Hersteller in so einem Fall geschickt vorgehen kann, zeigt die Projektdokumentation zur Entwicklung des Verlängerungsmarknagels Fitbone TAA. Diesen hat die Wittenstein Intens GmbH aus Igersheim entwickelt. Beim Erstellen der Dokumentation zum Fitbone-TAA-System haben Fachleute von Method Park aus Erlangen die Ingenieure von Wittenstein unterstützt. Um die Komplexität zu verwalten, wurde dabei für das Anforderungsmanagement das IBM-Tool Rational Doors verwendet.
Doch zunächst lohnt sich ein Blick auf das Medizinprodukt selbst. Das Fitbone-TAA-System besteht aus
- einem implantierbaren Verlängerungsmarknagel,
- einem Receiver, der unter der Haut implantiert wird,
- einem Steuerungsset, das den Marknagel von außen über den Receiver mit Energie versorgt, und
- verschiedenen OP-Instrumenten und Verriegelungsschrauben.
Das Steuerungsset und der Receiver sind dabei für alle Marknagelvarianten gleich. Den Marknagel selbst gibt es in Varianten, die sich etwa in Bezug auf Distraktionsstrecke oder Durchmesser unterscheiden. So lässt er sich zum Beispiel im Schienbein zur Beinverlängerung einsetzen, aber auch Varianten für den Oberschenkel sind verfügbar. Für jeden Typ des Marknagels werden spezifische OP-Instrumente benötigt.
Vielzahl einzelner Dokumente erstellen und verwalten
Alle diese Aspekte mussten dokumentiert werden. Einzelne Dokumente wurden erstellt, in denen es jeweils um folgende Aspekte ging:
- das Risiko,
- die Anforderungen,
- das Design,
- die Validierung und
- die Verifikation.
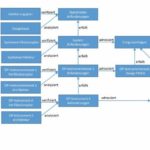
Im Tool Doors werden Dokumente als „formale Module“ bezeichnet. Die Inhalte stehen in Beziehung zueinander und sind miteinander verknüpft. Insgesamt sind es im Fall des Fitbone rund 100 Dokumente, die inhaltlich zusammenhängen.
Das Fitbone-TAA-System besteht aus vier Subsystemen, die in 16 Komponenten unterteilt sind. Dies ist auch bei der Dokumentation zu berücksichtigen. Als Subsystem sind zum Beispiel die jeweiligen OP-Instrumentensets anzusehen, als Komponenten die einzelnen OP-Instrumente.
Um diese Zusammenhänge abzubilden, mussten mehrere formale Module erstellt werden. Allein für die Dokumentation der OP-Instrumente entstanden auf der Subsystemebene fünf formale Module für die OP-Instrumentensets und 32 auf der Komponentenebene für einzelne OP-Instrumente. Insgesamt mussten auf Subsystemebene 25 und auf Komponentenebene sogar 54 formale Module verwaltet und verlinkt werden.
Um dabei die Übersicht zu behalten, wurde beim Planen der Arbeiten der Team Foundation Server (TFS) eingesetzt, eine Microsoft-Plattform für kollaborative Softwareprojekte. Inzwischen hat der Azure Devops Server den TFS abgelöst.
Eingerichtete Schnittstelle brachte zusätzliche Vorteile
Im Verlauf des Projektes erschien es sinnvoll, eigens eine Schnittstelle zwischen dem Anforderungsmanagement-Tool Doors und dem TFS einzurichten. So war ein Zugriff vom TFS aus auf die Doors-Datenbank möglich. Der Vorteil: Die Zusammenhänge zwischen den formalen Modulen, die in Doors in Linkmodulen abgebildet werden, ließen sich grafisch darstellen. So wurde einfach erkennbar, welche formalen Module bereits miteinander verlinkt wurden und welche nicht.
Darüber hinaus kann der TFS die Daten aus den Linkmodulen für automatische Checks verwenden. Ein Beispiel: Sind Einträge zu Anforderungen mit den entsprechenden Einträgen zu Verifikationen verlinkt? Falls ein solcher Link fehlt, gibt der TFS eine Warnung aus, was im beschriebenen Projekt Zeit und Geld bei formalen Reviews sparte. Ohne automatische Checks hätten diese Überprüfungen händisch erledigt werden müssen, was langwierig und auch fehleranfällig gewesen wäre.
Varianten im Produktportfolio – Baukasten zur Dokumentation
Eine weitere Herausforderung im Dokumentationsprojekt war, dass es nicht nur für den Fitbone TAA Varianten gab, sondern auch für weitere aktive und steuerbare Implantate wie Fitbone FSA/TSA, Fitbone SAA, Fitbone TAM und Fitspine, die das gleiche Steuerungsset verwenden. Daher wurde die Struktur in Doors anhand eines Baukastens aufgebaut. Auf diese Weise sollte vermieden werden, Informationen für mehrfach verwendete Teile aus dem Produktportfolio redundant zu verwalten. Um das zu erreichen, wurden systemspezifische formale Module definiert, die nur für den Fitbone TAA eingesetzt werden, sowie nicht-systemspezifische formale Module, etwa für das Steuerungsset.
Insgesamt war das Erstellen des Dokumentationsbaukastens in Doors für das Fitbone-TAA-System sehr zeitintensiv. Das war wegen des komplexen zu dokumentierenden Systems zu erwarten. Der Baukasten hat sich jedoch bewährt und die Übersichtlichkeit im gesamten Projekt deutlich verbessert. Zudem können, wie gewünscht, nicht-systemspezifische Informationen zentral verwaltet werden.
Auch das eigens für das Fitbone TAA System konfigurierte Zusammenspiel zwischen Doors und TFS war sehr hilfreich. Die initiale Verknüpfung der beiden Tools hat Zeit in Anspruch genommen. Bei den formalen Reviews hat sich jedoch gezeigt, dass sich die Mühe gelohnt hat, da durch die im TFS erzeugten Grafiken sowie die automatischen Checks Zeit und Aufwand eingespart wurden. Mit dem
für die Dokumentation gewählten Verfahren wurde so der Grundstein für zukünftige Projekte gelegt, in denen dann eine Zeitersparnis von bis zu 50 % erwartet wird.
Weitere Informationen
Die im Maschinenbau beheimatete Wittenstein SE, Igersheim, hat sich im Frühjahr 2020 von ihrer Medizinsparte getrennt: Die Orthofix Medical Inc. mit Hauptsitz in den USA hat das medizinische Produktportfolio Fitbone und Fitspine der Wittenstein-Tochter Wittenstein Intens GmbH übernommen. Für eine etwa zweijährige Übergangsphase bleibt die Produktion zunächst in Igersheim-Harthausen.
intens.wittenstein.de
Kontakt zum Dokumentationsexperten:
Method Park Holding AG
Wetterkreuz 19a
91058 Erlangen
Tel. +49 (0)9131 97206-286
www.methodpark.de